Recomendaciones provisionales actualizadas para el uso de medicamentos antivirales en el tratamiento y la prevención de la influenza durante la temporada 2009-2010
Este sitio web está archivado para fines históricos y ya no se le realizan mantenimiento ni actualizaciones. For updated information on the current flu season, see the Sitio web de los CDC sobre la influenza de temporada.
07 de diciembre de 2009, 5:00 p.m., hora del este
En esta página
- Objetivo
- Introducción
- Tratamiento de influenza confirmada o presunta
- Quimioprofilaxis antiviral de los individuos expuestos
- Uso de medicamentos antivirales para controlar brotes de influenza en instituciones
- Regímenes específicos para el tratamiento y la quimioprofilaxis de la influenza
- Consideraciones sobre la entrega y prescripción de antivirales
- Eventos adversos y contraindicaciones
- Más información
Estas recomendaciones contienen las siguientes actualizaciones:
- Información sobre el uso de peramivir intravenoso bajo una autorización de uso de emergencia
- Información sobre la disponibilidad de peramivir para pacientes con deterioro de la función renal
- Instrucciones actualizadas para la dosificación de oseltamivir en niños menores de 1 año según su peso
- Consideraciones sobre el tratamiento antiviral y la quimioprofilaxis en pacientes vacunados contra la influenza H1N1 2009 y la influenza de temporada
- Orientación en cuanto al tratamiento antiviral empírico temprano en pacientes con enfermedades similares a la influenza, progresivas o graves, independientemente de las afecciones médicas subyacentes
- Orientación en cuanto al tratamiento antiviral empírico temprano en pacientes con riesgo de desarrollar complicaciones a causa de afecciones médicas subyacentes
- Aclaración de consideraciones en cuanto al tratamiento de pacientes con la enfermedad de no más de 48 horas
Estas recomendaciones se centran en el uso de medicamentos antivirales para el tratamiento y la quimioprofilaxis de la influenza. A partir del 4 de diciembre de 2009, el virus (H1N1 2009) de la influenza A (H1N1) es la cepa responsable del >99% de los casos de influenza en los EE. UU. durante la temporada de influenza 2009-2010. Para más información sobre otros virus de la influenza, consulte el sitio web de los CDC. Estas recomendaciones fueron actualizadas por última vez el 4 de diciembre de 2009, y serán actualizadas periódicamente a medida que haya nueva información disponible.
Objetivo
Brindar recomendaciones actualizadas sobre el uso de agentes antivirales para el tratamiento y la profilaxis de la influenza durante la temporada de influenza 2009-2010.
Introducción
Hasta noviembre de 2009, ~99% de los virus de la influenza clasificados por tipo corresponden al virus H1N1 de 2009. La gran mayoría de los virus H1N1 2009 sometidos a prueba para determinar su resistencia a los medicamentos han resultado susceptibles al oseltamivir y zanamivir pero resistentes a los adamantanos (amantadina y rimantadina). Podrá encontrar datos sobre vigilancia, actualizados semanalmente, en Flu View semanal. Estas recomendaciones serán revisadas según sea necesario para adaptarlas a la nueva información sobre factores de riesgo, disponibilidad de los antivirales y resistencia a los mismos, o a la circulación de otros virus de la influenza.
En general, el tratamiento con un agente antiviral, en caso de ser indicado, debe comenzar tan pronto como sea posible una vez iniciados los síntomas típicos de una enfermedad similar a la influenza. La enfermedad de la influenza se puede presentar con una variada sintomatología: desde una infección de las vías respiratorias superiores de menor gravedad hasta una enfermedad aguda que pone en riesgo la vida.
- La enfermedad leve o sin complicaciones se caracteriza por síntomas típicos como la fiebre (aunque no todas las personas con influenza desarrollarán fiebre), tos, dolor de garganta, rinorrea, dolores musculares, dolor de cabeza, escalofríos, malestar, a veces diarrea y vómitos, pero sin falta de aire y pocos cambios en las afecciones crónicas.
- La enfermedad progresiva se caracteriza por síntomas típicos además de signos o síntomas que sugieren una enfermedad no tan leve: dolor en el pecho, poca oxigenación (por ejemplo, taquipnea, hipoxia, dificultad para respirar en los niños), insuficiencia cardiopulmonar (por ejemplo, presión arterial baja), lesiones de SNC (por ejemplo, confusión, estado mental alterado), deshidratación grave o exacerbación de enfermedades crónicas (por ejemplo, asma, enfermedad pulmonar obstructiva crónica, insuficiencia renal crónica, diabetes, u otras enfermedades cardiovasculares).
- La enfermedad grave o complicada se caracteriza por signos de enfermedad de las vías respiratorias inferiores (por ejemplo, hipoxia que requiere oxígeno adicional, radiografía anormal del pecho, ventilación mecánica), hallazgos con relación al SNC (encefalitis, encefalopatía), complicaciones asociadas a presión arterial baja (choques, insuficiencia orgánica), miocarditis o rabdomiólisis, o infección bacteriana secundaria invasiva sobre la base de pruebas de laboratorio o signos clínicos (por ejemplo, fiebre alta persistente y otros síntomas que se prolongan durante más de tres días).
Los virus de la influenza se contagian de persona a persona, principalmente mediante el contacto con secreciones respiratorias infectadas, principalmente a través de gotitas respiratorias transportadas por el aire al toser y estornudar. La reproducción y diseminación viral son consideraciones clave a la hora de decidir el momento en que se debe comenzar con el tratamiento, control de la infección, y la quimioprofilaxis. Por lo general, se calcula que el período de incubación de la influenza varía de 1 a 4 días con un promedio de 2 días. La propagación del virus de la influenza (el tiempo durante el cual una persona podría contagiar a otras) comienza el día antes de la aparición de la enfermedad y puede durar de 5 a 7 días, aunque algunas personas pueden diseminar el virus durante períodos más extensos, especialmente los niños pequeños y las personas inmunocomprometidas. La cantidad de virus que se disemina es mayor en los primeros 2-3 días y parece correlacionarse con la fiebre, con una mayor propagación cuando las temperaturas son más altas. En estos casos, sin embargo, el período de contagio comienza el día anterior a la aparición de la fiebre hasta 24 horas después de la desaparición de la fiebre.
Tratamiento de influenza confirmada o presunta
A quiénes se debe tratar
Se recomienda el tratamiento empírico inmediato para las personas con casos de infección presunta o confirmada por influenza y:
- Enfermedad que requiere hospitalización
- Enfermedad progresiva, grave o complicada, independientemente del estado de salud anterior, y/o
- Pacientes en riesgo de padecer una enfermedad grave (ver los grupos de alto riesgo más abajo)
Cómo tratarlos
- Medicamentos antivirales: oseltamivir (oral), zanamivir (para inhalar)
- Para obtener una guía detallada sobre la dosificación, consulte la tabla 1 que aparece a continuación
- Iniciar el tratamiento tan pronto como sea posible luego de la aparición de los síntomas
- Ofrecer tratamiento empírico antes de conocer los resultados de las pruebas de diagnóstico
- Cuando se indica un diagnóstico definitivo, solicitar pruebas de diagnóstico definitivo (rRT-PCR*, cultivo viral) en lugar de pruebas de diagnóstico rápido (RIDT*, DFA*)
* rRT-PCR: reacción en cadena de la polimerasa con transcriptasa inversa; RIDT: prueba de diagnóstico rápido de la influenza, DFA: ensayos por inmunofluorescencia directa
Medicamentos antivirales para tratar la influenza
Los inhibidores de la neuraminidasa son los medicamentos elegidos para el tratamiento de la influenza H1N1 2009 y las enfermedades similares a la influenza tanto en niños como en adultos en los EE. UU. actualmente.
Oseltamivir - El inhibidor de neuraminidasa conocido como oseltamivir y formulado como cápsulas o suspensión oral (Tamiflu®) cuenta con la aprobación de la FDA para el tratamiento de la influenza aguda sin complicaciones en pacientes de 1 año en adelante que han presentado síntomas por menos de 2 días. La FDA ha emitido una autorización de uso de emergencia (EUA) para permitir el tratamiento con oseltamivir en pacientes menores de 1 año que padecen influenza H1N1 2009. Además, la EUA autoriza el tratamiento de pacientes que presentan los síntomas de la influenza H1N1 2009 durante más de 2 días y de los pacientes lo suficientemente enfermos como para requerir hospitalización (ver www.cdc.gov/h1n1flu/eua/tamiflu.htm).
Zanamivir - El inhibidor de neuraminidasa zanamivir formulado para inhalación de administración oral (Relenza®) está aprobado por la FDA para el tratamiento de la influenza en pacientes de 7 años de edad en adelante, de manera similar a los usos aprobados del oseltamivir, que padecen una enfermedad sin complicaciones y han presentado síntomas durante no más de 2 días. Al igual que con el oseltamivir, la FDA ha emitido una EUA que autoriza el tratamiento con zanamivir de los pacientes con influenza H1N1 2009 que han presentado síntomas durante más de 2 días y de los pacientes lo suficientemente enfermos como para requerir hospitalización (ver www.cdc.gov/h1n1flu/eua/relenza.htm ).
Peramivir - Un tercer inhibidor de la neuraminidasa, el peramivir, formulado para su administración intravenosa (IV), es un producto experimental que actualmente está siendo evaluado mediante ensayos clínicos. A partir de octubre de 2009, se han enviado a la FDA datos sobre seguridad y/o eficacia de 1,891 pacientes con influenza A de temporada, aguda y sin complicaciones. No se ha evaluado la eficacia y seguridad en pacientes hospitalizados. Si bien los datos son insuficientes como para permitir la aprobación de la FDA, la misma entidad emitió una EUA para el tratamiento con peramivir de pacientes hospitalizados por influenza H1N1 2009 que tienen un caso de infección, posible o confirmada por laboratorio, que pone en riesgo sus vidas. El peramivir IV está disponible a través de los CDC mediante solicitud de un médico con licencia. Según la EUA, el tratamiento de pacientes adultos con peramivir IV está aprobado sólo en los siguientes casos: (1) el paciente no ha respondido a la terapia antiviral de administración oral o por inhalación; (2) la administración de un medicamento por una vía distinta a la intravenosa no se considera confiable o posible; o (3) el médico estima que la terapia IV es adecuada debido a otras circunstancias. El tratamiento de pacientes pediátricos está aprobado si se aplica alguno de los dos primeros criterios.
Pacientes que padecen una enfermedad progresiva grave y complicada, o que están hospitalizados
Se recomienda el tratamiento para pacientes con casos confirmados o presuntos de influenza H1N1 2009 que padecen una enfermedad progresiva grave con complicaciones o que están hospitalizados. Se recomienda el tratamiento por 5 días. Los pacientes hospitalizados con infecciones graves (como aquellos con infección prolongada o que requieren admisión en unidades de cuidados intensivos) pueden necesitar tratamientos más prolongados. Si bien el tratamiento es más eficaz cuando se comienza durante las primeras 48 horas de la enfermedad, algunos datos limitados obtenidos de estudios de observación de pacientes hospitalizados sugieren que el tratamiento de personas con una enfermedad prolongada o grave reduce la mortalidad o duración de la hospitalización, incluso cuando el tratamiento se comienza transcurridas más de 48 horas del inicio de la enfermedad. Las dosis antivirales recomendadas para el tratamiento de la influenza H1N1 2009 en adultos o niños de 1 año en adelante son las mismas que se recomiendan para la influenza de temporada (Tabla 1). Algunos expertos han propuesto la utilización de dosis dobles de oseltamivir para algunos pacientes gravemente enfermos, si bien no existen datos publicados que demuestren que las dosis más altas son más efectivas. En el caso de los pacientes que no pueden tomar medicamentos por vía oral o en quienes los medicamentos orales parecen no ser eficaces, el peramivir de administración intravenosa está disponible a través de los CDC bajo una EUA de la FDA, aunque los estudios sobre su eficacia y seguridad son escasos. Para obtener más información sobre el tratamiento de pacientes hospitalizados, consulte "Opciones de tratamiento antiviral, incluyendo peramivir intravenoso para el tratamiento de la influenza en pacientes hospitalizados durante la temporada 2009-2010" y "Recomendaciones actualizadas para los proveedores de servicios de salud de niños y adolescentes sobre el uso de medicamentos antivirales para el manejo de la influenza de temporada y la influenza H1N1 2009 durante la temporada 2009-2010”.
Pacientes con mayor riesgo de sufrir complicaciones
Se recomienda el tratamiento empírico inmediato con medicamentos antivirales para las personas con casos confirmados o presuntos de influenza que corren mayores riesgos de morbilidad y mortalidad graves. En base a los datos que están disponibles actualmente, aproximadamente el 70% de las personas hospitalizadas por influenza H1N1 2009 pertenecen a uno o más de los siguientes grupos:
- Niños (ver abajo) menores de 2 años de edad
- Adultos de 65 años de edad o mayores
- Mujeres embarazadas y mujeres en un período posparto de hasta 2 semanas (independientemente de cómo terminara el embarazo [nacimiento con vida, interrupción del embarazo, nacimiento prematuro, aborto espontáneo, muerte fetal])
- Personas con ciertos problemas de salud que se describen a continuación.
Niños: los niños menores de 2 años de edad corren mayores riesgos de sufrir complicaciones relacionadas con la influenza y registran un índice más alto de hospitalización comparado con el de niños mayores. Los niños de entre 2 y 4 años de edad tienen más probabilidades de requerir hospitalización o una evaluación médica urgente para detectar influenza, en comparación con los niños mayores y los adultos, si bien el riesgo es mucho menor que para los niños menores de 2 años. Desde abril hasta septiembre de 2009, los índices de hospitalización por casos de influenza H1N1 2009 confirmados por laboratorio eran 4.5 veces más altos entre los niños < 2 años, 2 veces más altos entre los niños de 2 a 4 años, y 1.6 veces más altos entre los niños de 5 a 17 años que entre los adultos (ver Flu View semanal). En abril de 2009, la FDA autorizó el uso de oseltamivir en los niños menores de 1 año bajo una autorización de uso de emergencia (EUA), en respuesta a la actual emergencia de salud pública que supone la influenza H1N1 de 2009. El uso del oseltamivir en niños menores de 1 año está sujeto a los términos y condiciones de la EUA. Los datos de seguridad retrospectivos sobre el tratamiento con oseltamivir para la influenza de temporada en niños menores de 1 año son limitados pero sugieren que los eventos adversos graves ocurren raramente. Se continúan recopilando datos potenciales sobre la seguridad y la eficacia del oseltamivir en este grupo etario. En la guía de la EUA, se puede encontrar información sobre la dosificación en niños menores de 1 año de edad. Se brindan detalles en la tabla 1 que se muestra a continuación. (Ver también: Autorización de uso de emergencia de Tamiflu (oseltamivir) disponible en /influenza h1n1/eua/). Los niños y adolescentes menores de 19 años que reciben una terapia a largo plazo a base de aspirinas también tienen más riesgos. Para obtener información más detallada, consulte "Recomendaciones actualizadas para los proveedores de servicios de salud de niños y adolescentes sobre el uso de medicamentos antivirales para el manejo de la influenza de temporada y la influenza H1N1 2009 durante la temporada 2009-2010".
Adultos de 65 años en adelante: si bien las personas de 65 años en adelante tienen menos probabilidades de enfermarse de influenza H1N1 2009 en comparación con las personas más jóvenes, cuando contraen influenza, estas personas tienen mayor riesgo de sufrir complicaciones graves relacionadas con la influenza.
Mujeres embarazadas: el embarazo aumenta el riesgo de sufrir complicaciones, de hospitalizaciones y de desarrollar una enfermedad grave. Un estudio estima que el riesgo de hospitalización por influenza H1N1 2009 es cuatro veces mayor para las mujeres embarazadas que para la población general (
Afecciones médicas: las siguientes afecciones médicas se han relacionado con un mayor riesgo de sufrir complicaciones por la influenza:
- Asma
- Enfermedades neurológicas o del neurodesarrollo [incluyendo trastornos del cerebro, la médula espinal, el nervio periférico y los músculos tales como parálisis cerebral, epilepsia (trastornos convulsivos), accidentes cerebrovasculares, incapacidad intelectual (retraso mental), retraso en el desarrollo de moderado a grave, distrofia muscular o lesión de la médula espinal].
- Enfermedades pulmonares crónicas (como enfermedad pulmonar obstructiva crónica [COPD] y fibrosis quística)
- Enfermedad cardíaca (como enfermedad cardíaca congénita, insuficiencia cardíaca congestiva y enfermedad de la arteria coronaria)
- Trastornos sanguíneos (como anemia falciforme)
- Trastornos endocrinos (como diabetes mellitus)
- Afecciones renales
- Enfermedades del hígado
- Trastornos metabólicos (como trastornos metabólicos congénitos y trastornos mitocondriales)
- sistema inmunológico debilitado debido a una enfermedad o medicamento (como las personas con VIH o SIDA, o cáncer o bien aquellas personas en tratamiento con esteroides por enfermedades crónicas)
- Personas menores de 19 años de edad que están recibiendo una terapia a largo plazo a base de aspirinas
Las autoridades de salud pública locales pueden brindar más pautas sobre la prioridad del tratamiento en grupos de alto riesgo de padecer complicaciones graves.
Evaluación clínica
Se puede considerar el tratamiento antiviral para la mayoría de las personas con un caso de infección confirmado o presunto por el virus de la influenza H1N1 2009 que desarrollaron una enfermedad respiratoria leve, sin complicaciones y espontánea, similar a la influenza de temporada común, y para aquellas personas que no requieren tratamiento por considerarse que no tienen un alto riesgo de desarrollar una enfermedad grave o complicada. Los beneficios de tratar a dichos pacientes pueden incluir una menor duración de la enfermedad. Sin embargo, en base a la experiencia con el tratamiento para la influenza de temporada, es posible que los pacientes que no se consideran en mayor riesgo de desarrollar enfermedades graves o complicadas y que padecen una enfermedad leve y sin complicaciones no se beneficien del tratamiento si éste se comienza después de 48 horas de la aparición de la enfermedad. Los criterios médicos siempre son importantes al momento de decidir sobre el tratamiento.
Las personas que ya se están recuperado de la influenza no necesitan medicamentos antivirales para tratamiento. Se deben considerar cuidadosamente las opciones para realizar un seguimiento exhaustivo. Los médicos clínicos que prefieren no tratar a sus pacientes empíricamente deben analizar los signos y síntomas del agravamiento de la enfermedad con tales pacientes y coordinar un seguimiento al menos por vía telefónica.
Algoritmo clínico para la consideración de la evaluación de las personas con influenza leve o sin complicaciones
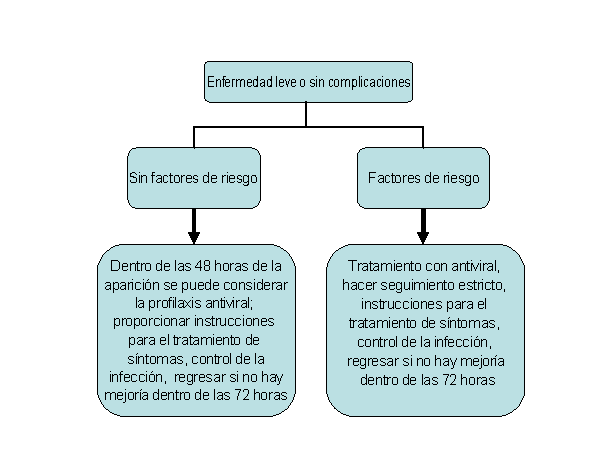
Inicio del tratamiento
El tratamiento se debe iniciar empíricamente en base a la evaluación clínica tan pronto como sea posible, incluso antes de disponer de los resultados definitivos de la prueba de diagnóstico, es decir, no se debe demorar el tratamiento a la espera de la confirmación de influenza por una prueba de laboratorio. El tratamiento es más eficaz cuando se comienza durante las primeras 48 horas de la enfermedad. Como se detalla más arriba, sin embargo, la evidencia sugiere que el tratamiento puede beneficiar a los pacientes con una enfermedad prolongada o grave incluso cuando se comienza transcurridas más de 48 horas luego del inicio de la enfermedad.
- Las pruebas definitivas para detectar la infección por influenza H1N1 2009 requieren la utilización de la técnica de reacción en cadena reversa de la transcriptasa-polimerasa (RT-PCR) en tiempo real o cultivo viral. Estas pruebas deben ser prioritarias para las personas con casos presuntos o confirmados de influenza que requieren ser hospitalizadas y de acuerdo con las pautas de los departamentos de salud locales y estatales.
- No se deben utilizar las pruebas de diagnóstico rápido de la influenza (RIDTs) para descartar la influenza porque los resultados negativos falsos son habituales. La sensibilidad de las pruebas rápidas para detectar el virus H1N1 2009 oscila del 10% al 70%. Los médicos clínicos no deben demorar el tratamiento en base al resultado negativo de una prueba rápida. Se puede encontrar información en línea sobre el uso de pruebas de diagnóstico rápido de la influenza (RIDT).
Los métodos para disminuir las demoras en el inicio de tratamiento incluyen:
- Informar a las personas con un mayor riesgo de sufrir complicaciones relacionadas con la influenza sobre los signos y síntomas de la influenza y la necesidad de comenzar un tratamiento luego de la aparición de los síntomas.
- Asegurar el acceso rápido a consultas telefónicas y evaluaciones clínicas a estos pacientes así como a pacientes que padecen una enfermedad grave.
- Considerar la posibilidad de realizar un tratamiento empírico de pacientes con mayor riesgo de desarrollar complicaciones por la influenza basado en comunicaciones telefónicas si no se ha indicado la hospitalización y si esto disminuirá sustancialmente la demora antes de iniciar el tratamiento.
- Solicitar a los pacientes con mayor riesgo de sufrir complicaciones por la influenza que se comuniquen con su proveedor de servicios de salud si desarrollan signos o síntomas de la influenza, si el proveedor les receta medicamentos, que los obtengan tan pronto como sea posible y que comiencen el tratamiento. Los proveedores deben tener en cuenta la confiabilidad del paciente, la habilidad para entender la información sobre los síntomas de la influenza y el acceso a una farmacia cuando buscan maneras para disminuir la demora en el tratamiento.
- Asesorar a los pacientes sobre los beneficios y efectos adversos de los antivirales para la influenza, el potencial de la constante susceptibilidad a la infección por el virus de la influenza después de que se realizó el tratamiento (debido a la circulación de otros virus de la influenza o en caso de que otra causa haya provocado la enfermedad), y la necesidad de buscar nuevamente asistencia médica temprana si los síntomas se repiten.
- Para las personas con exposición a la influenza, se recomienda el monitoreo directo por síntomas y el tratamiento temprano como alternativa a la quimioprofilaxis. Se puede asesorar a los integrantes del hogar o contactos directos (que presentan factores de riesgo de padecer complicaciones por la influenza) de casos presuntos o confirmados sobre los signos y síntomas tempranos de influenza y aconsejarles visitar inmediatamente a un proveedor de servicios de salud para un examen y la indicación de un tratamiento temprano en caso de que los signos o síntomas clínicos continúen.
Medidas de control de la infección para pacientes con tratamiento por la influenza
Las siguientes son recomendaciones para disminuir el contacto con pacientes infectados. Para recomendaciones más detalladas, "Quimioprofilaxis antiviral de las personas expuestas.”
Reducir el contagio a través de pacientes infectados
El intervalo de infección para la influenza se define en la introducción. Debido a que algunos estudios han demostrado que el tratamiento reduce la duración y la magnitud de la propagación viral, el tratamiento podría además reducir el contagio. Sin embargo, se debe informar a los individuos con síntomas que están bajo tratamiento que siguen siendo potenciales agentes de contagio. A pesar de estar realizando un tratamiento con agentes antivirales, los pacientes pueden seguir diseminando el virus de la influenza por un período de hasta cuatro o más días desde el comienzo de la terapia. Por lo tanto, los pacientes deben seguir el protocolo para el manejo de la tos, y las prácticas de higiene respiratoria y de manos durante toda la terapia para prevenir el contagio del virus a través del contacto directo.
Contacto cercano, para los fines de este documento, significa cuidar o vivir con una persona que es un caso confirmado, probable o presunto de influenza, o bien haber estado en un entorno donde hubo una alta probabilidad de haber estado en contacto con gotas de la respiración y/o fluidos corporales de dicha persona. Ejemplos de contacto cercano incluyen compartir los utensilios para comer o beber, o algún otro tipo de contacto entre personas con una alta probabilidad de estar expuestas a las gotas originadas por su respiración. El contacto cercano no incluye generalmente actividades como caminar junto a una persona infectada o sentarse en frente de un paciente sintomático en una sala de espera u oficina.
Los trabajadores del servicio de cuidados de salud deberían pedirle a sus pacientes que lleven a cabo estas medidas de comportamiento. Más medidas detalladas de control de la infección para individuos, para prevenir el contagio ocupacional, y para entornos institucionales se describen a continuación.
Proteger a los trabajadores del servicio de cuidados de salud
Las recomendaciones claves para proteger a los trabajadores del servicio de cuidados de salud de contagiarse con el virus de la influenza incluyen:
- Se deben establecer los controles administrativos adecuados (por ej.: que el personal de cuidados de salud permanezca en sus hogares si están enfermos y la identificación de pacientes con potenciales riesgos de infección), la higiene respiratoria y de manos, los equipos de protección personal, y la vacunación para reducir el riesgo de exposición o infección en el personal de cuidados de salud y personal de emergencia.
- Para más información, visite "Preguntas y respuestas sobre la Guía provisional de los CDC para las medidas de control de infecciones por influenza H1N1 2009 en ámbitos de cuidados de salud, incluyendo la protección del personal de los cuidados de salud"
Consideraciones adicionales para el tratamiento
Medicamentos para niños y de venta libre para el resfrío, incluyendo aspirina
No se debe administrar aspirina o productos que contengan aspirina (por ejemplo, subsalicilato de bismuto - Pepto Bismol) a cualquier niño o adolescente menor de 19 años con influenza confirmada o presunta debido al riesgo de padecer síndrome de Reye. Se recomiendan otros medicamentos antipiréticos para aliviar la fiebre como el acetaminofeno o medicamentos antiinflamatorios no esteroides. Los niños menores de 4 años no deben recibir medicamentos de venta libre para el resfrío sin una consulta previa con un proveedor de servicios de salud.
Vacunación previa contra la influenza H1N1 2009 o la influenza de temporada
Los virus de la influenza de temporada también podrían circular y causar enfermedades en la temporada de influenza 2009-2010. Es posible que los brotes del virus H1N1 2009 se produzcan en forma simultánea. La gravedad, la cantidad de casos que provocarán y el momento en que aparecerán las enfermedades causadas por la influenza H1N1 2009 y la influenza de temporada son inciertos. En octubre de 2009, las vacunas monovalentes contra la influenza H1N1 2009 en fórmulas inactivas y atenuadas en virus vivos estuvieron disponibles en los Estados Unidos. Todas las personas que se encuentran en un grupo objetivo de vacunación deberían recibir la vacuna monovalente contra la influenza H1N1 2009 y la vacuna contra la influenza de temporada..
Existen pocas probabilidades de que la vacuna contra la influenza de temporada proporcione protección contra la influenza H1N1 2009 o vice versa. Además, estas vacunas no son efectivas en un 100% contra la infección. Tampoco son eficaces inmediatamente después de su administración. Deben pasar al menos 2 semanas para que la vacuna tenga efecto. Por lo tanto, haber recibido la vacunación no descarta que se pueda padecer influenza. La vacunación previa no es una contraindicación para el tratamiento con medicamentos antivirales.
La recomendaciones de tratamiento para los individuos que recibieron la vacuna deben ser las mismas que para las personas que no se vacunaron.
Las personas que recibieron las vacunas contra la influenza atenuadas en virus vivos y que tomaron medicamentos antivirales dentro de las 48 horas antes o hasta dos semanas después de haber sido vacunadas pueden no tener inmunidad y deberán recibir nuevamente la vacuna.
Coinfección bacteriana
Se recuerda a los médicos clínicos tener en cuenta las coinfecciones bacterianas que pueden ocurrir durante o después del contagio con influenza. Por lo tanto, el tratamiento empírico de la neumonía contraída en la comunidad debe incluir oseltamivir y medicamentos antivirales cuando el virus de la influenza circula en la comunidad y el médico clínico considera que la influenza puede causar o coincidir con la neumonía contraída. (Vea Pautas de la Sociedad Estadounidense de Enfermedades Infecciosas / Pautas de Consenso de la Sociedad Torácica Estadounidense sobre el Control de la Neumonía contraída en la comunidad en Adultos. Enfermedades infecciosas 2007;44:S27-72).
Tratamiento de la influenza cuando circulan virus resistentes al oseltamivir
La resistencia al oseltamivir es común entre los virus de la influenza A (H1N1) de temporada. Por lo general, estos virus permanecen susceptibles al zanamivir, la rimantadina y la amantadina. Sin embargo, desde abril de 2009, muy pocos virus de la influenza de temporada H1N1 han circulado en los Estados Unidos. Por lo tanto, el tratamiento, si es indicado, con oseltamivir o zanamivir es adecuado. En caso de que los datos de vigilancia del virus indicaran que los virus H1N1 de temporada resistentes al oseltamivir se han vuelto más comunes o se relacionan con brotes identificados en las comunidades, se debería condiderar el uso de zanamivir o una combinación de oseltamivir y rimantadina o amantadina como tratamiento empírico en pacientes que pueden tener infección por el virus de la inluenza A (H1N1) de temporada resistente al oseltamivir. Los datos de la vigilancia nacional sobre los virus de la influenza que circulan en los Estados Unidos están disponibles en el Flu View semanal. Los departamentos de salud estatales y locales también constituyen una fuente de información de la vigilancia del virus en algunas áreas. La guía sobre las recomendaciones de tratamiento empírico cuando circulan múltiples cepas de influenza está disponible en "Los CDC emiten Recomendaciones provisionales para el uso de medicamentos antivirales para la influenza en entornos donde circulan virus de la influenza A (H1N1) e influenza de temporada 2008-09 resistentes al oseltamivir".
Quimioprofilaxis antiviral de los individuos expuestos
Definiciones utilizadas; quiénes deber ser tratados en manera de profilaxis
período infeccioso
- El día anterior a la aparición de la fiebre hasta 24 horas después de la desaparición de la fiebre.
El contacto directo según las formas posibles de contagio
- Exposición a las gotas respiratorias de las superficies mucosas (por ejemplo, la nariz, la boca y los ojos) a través de las secreciones respiratorias en la tos y el estornudo
- Contacto, generalmente con las manos, con un paciente o fómite infectados (una superficie que está contaminada con secreciones) seguido de la autoinoculación del virus en las superficies mucosas como las de la nariz, la boca y los ojos, y
- Aerosoles de pequeñas partículas en la cercanía de la persona infectada.
Quiénes deben ser considerados para recibir la quimioprofilaxis antiviral
- Las siguientes personas que tengan contacto cercano con un individuo con infección presunta o confirmada por influenza H1N1 2009 durante el período de infección:
- Personas con alto riesgo de padecer complicaciones por la influenza;
- Trabajadores de los cuidados de salud y servicios de emergencia;
- Mujeres embarazadas.
Quiénes no deben recibir la quimioprofilaxis
- Grupos de niños o adultos sanos basado en la potencial exposición en la comunidad, lugar de trabajo, escuela, campamentos u otros entornos;
- Si han pasado >48 horas desde el último contacto cercano con una persona enferma
- El contacto cercano con una persona enferma no ocurrió durante el período de contagio
Cómo realizar la profilaxis
- Medicamentos antivirales: oseltamivir (oral), zanamivir (para inhalar)
- Para obtener una guía detallada de la dosificación, vea las tablas 1 y 2 más abajo
Considere el tratamiento temprano de la enfermedad como una alternativa a la quimioprofilaxis
Medicamentos antivirales para la quimioprofilaxis
Los inhibidores de neuraminidasa, oseltamivir y zanamivir, son los medicamentos que se utilizan en este momento para la quimioprofilaxis en niños y adultos expuestos a la influenza H1N1 2009 en los EE. UU. El oseltamivir formulado como cápsulas o suspensión oral (Tamiflu®) cuenta con la aprobación de la FDA para la profilaxis de la influenza en pacientes de 1 año de edad y mayores. La FDA ha emitido una autorización de uso de emergencia para el uso de oseltamivir para la profilaxis en pacientes menores de 1 año de edad (vea www.cdc.gov/h1n1flu/eua/tamiflu.htm). El zanamivir formulado para inhalación de administración oral (Relenza®) está aprobado por la FDA para la profilaxis de la influenza en pacientes de 5 años de edad y mayores. La duración de la quimioprofilaxis es de 10 días. A continuación se describen las recomendaciones para la profilaxis con estos medicamentos de los actuales nuevos virus de la influenza H1N1 2009 que circulan, al igual que las hojas de datos desarrolladas bajo autorización de uso de emergencia (vea Relenza y Tamiflu ).
El tratamiento temprano de la enfermedad como una alternativa a la quimioprofilaxis
Se hace hincapié en la detección y el tratamiento temprano de la enfermedad como una alternativa a la quimioprofilaxis después de una posible exposición.
- Se puede asesorar a las personas que presentan factores de riesgo de sufrir complicaciones por la influenza y que son miembros del hogar o tienen contacto directo con casos presuntos o confirmados, y al personal de asistencia médica que tienen exposiciones en el lugar de trabajo sobre los signos y síntomas tempranos de influenza y aconsejarles visitar inmediatamente a un proveedor de servicios de salud para un examen y la indicación de un tratamiento temprano en caso de que desarrollen signos o síntomas clínicos.
- Los proveedores de servicios médicos deben usar los criterios clínicos en relación a las situaciones en las que la detección y tratamiento temprano de la enfermedad pueden ser una alternativa adecuada a la quimioprofilaxis.
- Se prefiere la detección y el tratamiento temprano de la enfermedad, si es indicado, a la quimioprofilaxis en personas sanas vacunadas, incluyendo el personal de cuidados de salud, después de una supuesta exposición.
Se debe informar a los pacientes que administran la quimioprofilaxis después de la exposición que tal tratamiento disminuye pero no elimina el riesgo de padecer la influenza y que la protección finaliza cuando no se toman más los medicamentos. Se debe alentar a los pacientes sometidos a quimioprofilaxis a buscar evaluación médica tan pronto como desarrollen una enfermedad respiratoria febril que puede indicar la presencia de influenza.
Uso de medicamentos antivirales para controlar los brotes en instituciones
El uso de medicamentos antivirales para el tratamiento y la quimioprofilaxis de la influenza ha sido el pilar más importante para el control de los brotes de influenza de temporada en asilos de ancianos y otros centros de cuidados a largo plazo que albergan una gran cantidad de pacientes con alto riesgo de sufrir complicaciones por la influenza. (Ver MMWR: Prevención y control de la influenza: Recomendaciones del Comité Asesor sobre Prácticas de Inmunización (ACIP), 2008). Desde el 29 de octubre de 2009, no se han registrado brotes de la influenza H1N1 2009 en asilos de ancianos, si bien se ha informado sobre un caso un centro de cuidado a largo plazo. Cuando se registran brotes de la influenza H1N1 2009 en esos centros, se recomienda que los pacientes enfermos sean tratados con oseltamivir o zanamivir y que la quimioprofilaxis, ya sea con oseltamivir o zanamivir, se comience cuanto antes para disminuir la diseminación del virus tal como se indica para los brotes de influenza de temporada en dichos entornos. Se pueden encontrar pautas adicionales sobre las medidas de control de la infección en centros de cuidados a largo plazo en: Uso de medicamentos antivirales para controlar los brotes de influenza en las instituciones.
Además de implementarse en los asilos de ancianos, la quimioprofilaxis antiviral también puede ser considerada para controlar los brotes de influenza en otros entornos cerrados o semicerrados (por ejemplo: instituciones correccionales u otros lugares en los que personas viven en estrecha proximidad) en donde se aloja una gran cantidad de personas con alto riesgo de padecer complicaciones por la influenza. Para obtener más información sobre los brotes de influenza en instalaciones ver:
- Prevención y control de la influenza: Recomendaciones del Comité Asesor sobre Prácticas de Inmunización (ACIP), 2008
- Influenza de temporada en adultos y niños - Diagnóstico, tratamiento, quimioprofilaxis y manejo institucional del brote: pautas de práctica médica de la Sociedad Estadounidense de Enfermedades Infecciosas
- Guía provisional para instituciones correccionales y de detención sobre el virus de la nueva influenza tipo A (H1N1)
- Guía provisional sobre el nuevo virus de la influenza A (H1N1) para refugios de emergencia
Los brotes de influenza en las escuelas, los campamentos, los lugares de trabajo y otros entornos de grupo no deben ser controlados mediante la administración de quimioprofilaxis a todas las personas potencialmente expuestas a los virus de la influenza. Se debe educar a las poblaciones sanas generalmente presentes en estos entornos sobre los signos y síntomas de la influenza, e instar a que consulten a sus proveedores de servicios de salud si desarrollan una enfermedad grave. La quimioprofilaxis después de la exposición puede ser considerada en las personas que presentan los criterios de exposición antes mencionados y que tienen una afección médica o que pertenecen a un grupo etario con mayores riesgos de sufrir complicaciones por la influenza. El énfasis en la evaluación y el tratamiento temprano, tal como se describe anteriormente, es una alternativa. Asimismo, se debe educar a las personas en estos entornos sobre las medidas de higiene y control de la infección que pueden disminuir el contagio de los virus de la influenza.
Regímenes específicos para el tratamiento y quimioprofilaxis de la influenza A H1N1 2009
Regímenes de quimioprofilaxis y tratamiento para adultos y niños según la edad y el peso
Consideraciones sobre la entrega y prescripción de antivirales
Alternativas a la suspensión oral de Tamiflu® en pacientes pediátricos
Si bien se recomienda la suspensión oral de Tamiflu® fabricada comercialmente (12 mg/mL) en pacientes con dificultad para tragar cápsulas o que requieren dosis más bajas, es posible que este producto no esté disponible a nivel local.
Para los pacientes menores de un año, existe una alternativa:
- una suspensión formulada por un farmacéutico minorista (Información de seguridad de medicamentos de la FDA: Preparación de emergencia de una suspensión oral a partir de cápsulas de Tamiflu® de 75 mg (concentración final de 15 mg/mL))
Para los niños que tienen al menos un año de edad, existen dos alternativas:
- una suspensión formulada por un farmacéutico minorista (el mismo enlace de arriba)
- cápsulas de 30 mg, 45 mg o 75 mg, las cuales pueden ser mezcladas dentro de un líquido dulce por un cuidador, en caso de que el niño no pueda tragar las cápsulas ("Cómo abrir y mezclar cápsulas de Tamiflu con líquidos si los niños no pueden tragar las cápsulas"
Suspensión elaborada de Oseltamivir - Posibles errores de dosificación
La concentración de la suspensión oral de Tamiflu® de elaboración comercial es de 12 mg/mL; la concentración de la suspensión elaborada es de 15 mg/mL.
Al recetar la suspensión oral de Tamiflu®, el médico debe especificar si la concentración está determinada en mL o cucharaditas, o bien recetar la dosis en miligramos (mg).
Se puede encontrar más información en:
- Influenza H1N1: recursos para farmacéuticos
- Alerta de seguridad del Instituto para el Uso Seguro de los Medicamentos: La escasez de la suspensión oral de Tamiflu® contribuye a errores de dosificación
Suspensión oral comercial de Tamiflu® - Posibles errores en los dispositivos de dosificación
Los farmacéuticos que tengan acceso a la suspensión oral de Tamiflu® deben tener en cuenta que en el empaque del producto del fabricante se incluye un dosificador oral con graduaciones de 30 mg, 45 mg y 60 mg, en lugar de graduaciones en mililitros (mL) o cucharaditas (tsp, abreviatura en inglés). Se han registrado casos en los que las unidades de medición en las instrucciones para la administración de la dosis (mililitros o cucharadas) no se corresponden con las unidades del dispositivo de dosificación (mg), lo que provoca confusiones y errores en la dosificación. Al suministrar la suspensión oral de Tamiflu® de fabricación comercial, los farmacéuticos deben verificar que las unidades de medición en las instrucciones sobre las dosis coincidan con el dispositivo de dosificación. Si las instrucciones para la administración del medicamento especifican la dosificación en mililitros o cucharadas, el dispositivo que se incluye en el empaque de Tamiflu® debe retirarse y y reemplazarse por un dispositivo de medición adecuado.
Al suministrar la suspensión oral del TAMIFLU® fabricada comercialmente, debe asegurarse de que las unidades de medición en las instrucciones sobre la dosis coincidan con el dispositivo de dosificación provisto. En el caso de los niños menores de 1 año de edad, siempre se debe retirar el dosificador oral que se incluye en el empaque del producto y reemplazarlo por un dispositivo de medición adecuado < 30 mg.
Se puede encontrar más información en:
- Influenza H1N1: recursos para farmacéuticos
- Alerta de salud pública de la FDA: Posibles errores en la medicación con la suspensión oral de Tamiflu
Eventos adversos y cotraindicaciones
Por lo general, la tolerancia al oseltamivir y zanamivir es muy buena dentro de los grupos etarios aprobados por la FDA. Se informaron náuseas y vómitos más frecuentemente en adultos que administraban oseltamivir para el tratamiento (aproximadamente el 10% informó náuseas sin vómitos y aproximadamente el 9% informó vómitos) que en personas que administraban placebo (aproximadamente el 6% informó náuseas sin vómitos y aproximadamente el 3% informó vómitos). En los niños tratados con oseltamivir, el 14% tuvo vómitos, en comparación con el 8.5% de pacientes al que se administró placebo. La suspensión de oseltamivir se formula con sorbitol, que puede asociarse con diarrea y dolor abdominal en pacientes que no toleran la fructosa. Los datos de seguridad retrospectivos sobre el tratamiento con oseltamivir para la influenza de temporada en niños menores de 1 año son limitados y sugieren que los eventos adversos graves ocurren raramente. Se continúan recopilando datos potenciales sobre la seguridad y la eficacia del oseltamivir en este grupo etario. Se han reportado reacciones alérgicas (erupciones, inflamación del rostro o la lengua, anafilaxis) en ensayos clínicos, con oseltamivir y con zanamivir.
El zanamivir, un medicamento de inhalación, puede provocar broncoespasmos y no se recomienda para el tratamiento de pacientes con mayor riesgo subyacente de padecer broncoespasmos. El zanamivir debe administrarse únicamente tal como se indica en la información de la receta utilizando el dispositivo Diskhaler que se proporciona con el producto. La fórmula comercial de zanamivir (polvo para inhalación Relenza®) es una mezcla de sustancia activa denominada zanamivir y un portador de lactosa. Esta fórmula no está diseñada ni destinada para su uso en ningún nebulizador ni respirador mecánico, ya que existe riesgo de que el azúcar de la lactosa los obstruya, dificultando el funcionamiento adecuado de los respiradores mecánicos. Si bien existen informes, tanto publicados como no publicados, acerca de la utilización de zanamivir a través de un nebulizador y su mascarilla en ensayos clínicos, la fórmula comercial disponible actualmente no está diseñada ni destinada para administrarse con nebulizaciones.
Se han reportado unos pocos casos de eventos neuropsiquiátricos transitorios (autoflagelación o delirios) en personas que tomaron oseltamivir y zanamivir, durante los controles posteriores al inicio de su comecialización. La mayoría de los informes surgieron de niños y adolescentes que vivían en Japón. Debido a que la propia influenza puede estar asociada a una variedad de síntomas neurológicos y de comportamiento, incluyendo convulsiones, delirio y alucinaciones, no queda claro si los inhibidores de la neuraminidasa son directamente responsables por estos efectos neuropsiquiátricos. Hasta la fecha, los análisis retrospectivos conducidos por Roche, el fabricante del oseltamivir, no han hallado evidencia de un riesgo mayor de eventos neuropsiquiátricos después del uso del oseltamivir. Hasta que existan más datos disponibles, la FDA aconseja que se controle a las personas que reciban inhibidores de la neuraminidasa en busca de comportamientos anormales. Para obtener más información, remítase al Alerta de seguridad de FDA MedWatch: Tamiflu®.
Los datos sobre la seguridad de Peramivir IV son limitados y están resumidos en la hoja de datos para profesionales de los cuidados de salud de la EUA. Después de una sola dosis de 200 mg o 400 mg de peramivir IV, los efectos clínicos adversos y las anomalías de laboratorio no eran más frecuentes que con el placebo. Entre los pacientes hospitalizados tratados por 5 días con peramivir IV, 200 mg o 400 mg, la totalidad de los eventos adversos se registraron en el 54% de los pacientes, comparado con el 41% de los pacientes tratados con 75 mg de oseltamivir vía oral, dos veces por día. Se registraron eventos adversos graves en un 4% de los pacientes que recibieron 200 mg una vez al día, un 17% de los pacientes que recibieron 400 mg y un 9% de los pacientes que recibieron oseltamivir. La diarrea y los eventos psiquiátricos fueron más comunes entre las personas que recibieron peramivir que entre aquellos que recibieron oseltamivir. En términos de parámetros de laboratorio, los médicos clínicos deberían realizar un monitoreo del conteo sanguíneo, electrolitos, la función renal, análisis urinarios y del perfil hepático, según las recomendaciones de la EUA. Debido a la limitada información disponible sobre el uso del peramivir, los requisitos obligatorios de envío de informes son parte de las condiciones de la EUA. Los proveedores de servicios de salud (o quienes sean designados) deben notificar al programa MedWatch de la FDA sobre los eventos adversos y todo tipo de error farmacológico relacionado con el uso de peramivir dentro de los 7 días calendarios de la aparición del evento, incluyendo un seguimiento, según lo requerido.
Informar eventos adversos
Los profesionales de los cuidados de salud deben informar de inmediato todos los eventos adversos graves (SAE) después del uso de medicamentos antivirales a MedWatch, el programa de denuncias de la FDA sobre eventos adversos de medicamentos.
Para obtener mayor información
Para obtener más información sobre la influenza y los medicamentos antivirales, incluyendo las contraindicaciones y los efectos adversos, consulte las siguientes fuentes:
- Preguntas y respuestas: Medicamentos antivirales para la temporada de influenza 2009-2010
- Agentes antivirales para la influenza de temporada: efectos secundarios y reacciones adversas.
- Harper SA, Bradley JS, Englund JA, et al. Pautas de la Sociedad Estadounidense de Enfermedades Infecciosas. Influenza de temporada en adultos y niños - Diagnóstico, tratamiento, quimioprofilaxis y manejo institucional del brote: pautas de práctica médica de la Sociedad Estadounidense de Enfermedades Infecciosas
- Jain, S et al. Pacientes hospitalizados con influenza H1N1 2009 en los Estados Unidos, abril-junio de 2009. N Engl J Med 2009;361.
- Jamieson DJ, et al. Infección por el virus de la influenza H1N1 2009 durante el embarazo en Estados Unidos. Lancet 2009;374:451-8.
- CDC. Pacientes en cuidados intensivos con el virus de la nueva influenza A (H1N1) --- Michigan, junio de 2009. Informe semanal de morbilidad y mortalidad (MMWR) 2009:58:749-52.
- Rasmussen SA. Influenza pandémica y mujeres embarazadas: resumen de una reunión entre expertos. Am J Public Health 2009; 99 (S2): S248-S254.
Los enlaces a los sitios web de organizaciones que no pertenecen al Gobierno Federal se brindan sólo como un servicio a nuestros usuarios. Estos enlaces no constituyen un aval a estas organizaciones o a sus programas por parte de los CDC o el Gobierno Federal, y no debería hacerse inferencia alguna al respecto. Los CDC no son responsables del contenido que se encuentra en los enlaces de los sitios web de cada una de las organizaciones.
Reciba actualizaciones por correo electrónico
Para recibir actualizaciones por correo electrónico sobre este sitio, ingrese su dirección de correo electrónico:
Contáctenos:
- Centros para el Control y la Prevención de Enfermedades
1600 Clifton Rd
Atlanta, GA 30333 - 800-CDC-INFO
(800-232-4636)
TTY: (888) 232-6348
Las 24 horas/todos los días - cdcinfo@cdc.gov





