|
(This document
in English)
FDA EINFUHRVORSCHRIFTEN
|
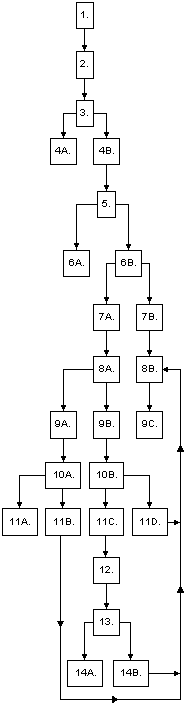 |
1. |
Die Einfuhrdokumente sind innerhalb von 5 Werktagen nach Eingang einer
Sendung durch den Importeur oder seinem Agenten bei den U.S. Zollbehörden
vorzulegen. |
| 2. |
Zur Benachrichtigung der FDA über die Einfuhr unter diese Vorschriften
fallender Nahrungsmittel sind folgende Dokumente beizubringen:
-
Zolleinfuhrdokumente (CF 3461, CF 3461 ALT, CF 7501 oder entsprechende),
in doppelter Ausführung,
-
Kopien der Rechnung und,
-
der Bescheinigung über die Hinterlegung einer Sicherheit für
anfallende Zollgebühren, Steuern oder Strafgebühren.
|
| 3. |
Die FDA prüft die Einfuhrdokumente des Importeurs daraufhin, ob
eine Warenbeschau, eine Prüfung am Entladedock oder eine Probenuntersuchung
erforderlich ist. |
| 4A. |
Es wird entschieden, keine Probe zu entnehmen. Die FDA schickt einen
Freigabebescheid (May Proceed Notice) an den U.S. Zoll und an den offiziellen
Importeur. Die Ladung ist von der FDA freigegeben. |
| 4B. |
Es wird entschieden, eine Warenprobe zu nehmen aufgrund:
-
des Produkttyps,
-
von Prioritäten der FDA,
-
der Vorgeschichte der Ware.
Die FDA schickt einen Bescheid über Probennahme (Notice of Sampling)
an die U.S. Zollbehörden und an den offiziellen Importeur. Die Sendung
darf nicht geöffnet werden bis ein weiterer Bescheid ergeht. Der Sendung
wird eine Probe entnommen. The offizielle Importeur darf die Sendung vom
Dock in eine anderen Hafen oder in ein anderes Lager bringen (kontaktieren
Sie die U.S. Zollbehörden für genauere Details). |
| 5. |
Die FDA entnimmt eine Materialprobe. Die Probe wird zwecks Analyse
zu einem Regionallabor der FDA geschickt. |
| 6A. |
Die FDA Analyse ergibt, daß die Probe den Vorschriften entspricht.
Die FDA schickt einen Freigabebescheid (Release Notice) an die U.S. Zollbehörden
und an den offiziellen Importeur. |
| 6B. |
Die FDA Analyse ergibt "Hinweise", daß die Probe gegen die FD&C
(Food, Drug & Cosmetics = Nahrungsmittel, Pharmazeutika & Kosmetika)
Verordnung bzw. andere relevante Verordnungen verstößt.
Die FDA schickt einen Bescheid über Beschlagnahmnung und Anhörung
(Notice of Detention and Hearing) an die U.S. Zollbehörden und den
offiziellen Importeur, mit folgendem Inhalt:
-
Art des vorliegenden Verstoßes, und der Bescheid,
-
daß der offizielle Importeur Gelegenheit erhält, innerhalb von
10 Werktagen die Zulässigkeit der Sendung schriftlich zu belegen.
Diese Anhörung ist für den offiziellen Importeur die einzige
Gelegenheit zur Verteidigung des betreffenden Imports und zur Vorlage von
Beweismaterialien, aus denen hervorgeht, aufgrund welcher Tatsachen eine
Einfuhr der Sendung zulässig wäre. |
| 7A. |
Die Beantwortung des Beschlagnahmungs- und Anhörungsbescheides
kann durch den Empfänger, den Eigner, den offiziellen Importeur oder
durch einen von ihnen bestellten Vertreter erfolgen. Als Antwort sind sowohl
mündliche als auch schriftliche Aussagen zur Zulässigkeit der
Sendung erlaubt. |
| 7B. |
Weder der Empfänger, der Eigner, der offizielle Importeur, noch
ein von ihnen bestellter Vertreter antwortet auf den Beschlagnahmungs-
und Anhörungsbescheid, noch wird ein Antrag auf Fristverlängerung
für die Anhörung gestellt. |
| 8A. |
Die FDA hält eine Anhörung zur Zulässigkeit des Produktes
ab. Die Anhörung gibt Gelegenheit zur Vorlage relevanter Tatsachen,
und lediglich diesbezügliche Dokumentationen sind zur Vorlage zulässig. |
| 8B. |
Die FDA stellt dem offiziellen Importeur einen Bescheid über Verweigerung
einer Einfuhrgenehmigung (Notice of Refusal of Admission) zu. Es handelt
sich hierbei um die gleiche Person oder Firma, der der Bescheid über
Probennahme zugestellt wurde. Den Adressaten des Bescheids über Probennahme
und des Bescheids über Beschlagnahme und Anhörung geht eine Kopie
des Ablehnungsbescheides zu. |
| 9A. |
Der offizielle Importeur legt Beweise für die Zulässigkeit
des Produkts vor. Beglaubigte Untersuchungsergebnisse von in einem zuverlässigen
Labor durchgeführten Proben-Analysen, deren Werte für in menschlichen
Nahrungsmitteln zulässige Verunreinigungen und Mängel innerhalb
der veröffentlichten Richtlinien liegen, können vorgelegt werden. |
| 9B. |
IDer offizielle Importeur stellt einen Antrag auf Zulassung einer Aufbereitungsmaßnahme
oder auf Durchführung sonstiger Maßnahmen (FDA Formular FD 766).
Es handelt sich hierbei um einen Antrag auf Erlaubnis, ein verdorbenes
oder fehldeklariertes Nahrungsmittel durch Umdeklarierung oder sonstige
Maßnahmen oder durch Umbestimmung zur Verwendung zu anderen als Nahrungszwecken
mit den geltenden Bestimmungen in Einklang zu bringen. Es ist im Detail
anzugeben, wie diese Übereinstimmung erreicht werden soll. |
| 9C. |
Der FDA geht eine Exportbestätigung oder eine Bescheinigung über
die Vernichtung der Sendung von den U.S. Zollbehörden zu. Die Ausfuhr
bzw. Vernichtung der auf dem Bescheid über die Verweigerung einer
Einfuhrgenehmigung genannten Waren erfolgt unter Aufsicht der U.S. Zollbehörden. |
| 10A. |
Die FDA nimmt eine zweite Probe zwecks Untersuchung auf Übereinstimmung
mit den Richtlinien. |
| 10B. |
Die FDA beurteilt die vom Importeur vorgeschlagene Aufbereitungsmethode.
Für die Bezahlung von *liquidated damages* ist die Hinterlegung einer
Sicherheit erforderlich. |
| 11A. |
Die FDA befindet, daß die Probe "den Richtlinien entspricht".
Ein Freigabebescheid mit der Bemerkung "Nach Beschlagnahmung freigegeben"
(Originally Detained and Now Released) ergeht an die U.S. Zollbehörden
und an den Importeur. |
| 11B. |
Die FDA befindet, daß die Probe nicht den Richtlinien entspricht.
Der Importeur stellt entweder einen Antrag auf Zulassung einer Aufbereitungsmaßnahme
oder auf Durchführung sonstiger Maßnahmen (siehe 9B), andernfalls
erläßt die FDA einen Bescheid über die Verweigerung einer
Einfuhrgenehmigung (siehe 8B). |
| 11C. |
Die FDA stimmt den Aufbereitungsmaßnahmen des Importeurs zu.
Der positiv beschiedene Antrag enthält die Bemerkung "Bis zum Erhalt
des Freigabebescheides der FDA ist die Sendung intakt zu belassen." |
| 11D. |
Die FDA verweigert die Zustimmung zu der vom Importeur vorgeschlagenen
Aufbereitungsmethode, wenn diese aufgrund vorliegender Erfahrungen nicht
erfolgversprechend erscheint. Einem zweiten Antrag kann nur stattgegeben
werden, wenn die darin vorgeschlagene Aufbereitung sich wesentlich von
der vorherigen unterscheidet und von deren Erfolg auszugehen ist. Weitere
Anträge sind nicht zulässig. Der Bescheid ergeht an den Antragsteller
auf FDA Formular FD 766. |
| 12. |
Der Importeur führt alle Aufbereitungsmaßnahmen durch und
macht Mitteilung an die FDA, daß die Waren zur Inspektion/Probennahme
bereit sind. |
| 13. |
Die FDA führt eine zweite Inspektion/Probennahme durch, zwecks
Feststellung, ob die Aufbereitung im Sinne der Genehmigung durchgeführt
wurde. |
| 14A. |
Die FDA-Analyse ergibt, daß die Probe den Richtlinien entspricht.
Ein Freigabebescheid ergeht an den Importeur und an die U.S. Zollbehörden.
Kostenstellung für die Überwachungstätigkeit der FDA erfolgt
auf FDA Formular FD 790. Die U.S. Zollbehörden erhalten Kopien und
sind verantwortlich für den Einzug der Gesamtkosten einschließlich
der den Zollbeamten enstandenen Kosten. |
| 14B. |
Die FDA-Analyse ergibt, daß die Probe noch immer nicht den Richtlinien
entspricht. Kostenstellung für die Überwachungstätigkeit
der FDA erfolgt auf FDA Formular FD 790). Die U.S. Zollbehörden erhalten
Kopien und sind verantwortlich für den Einzug der Gesamtkosten einschließlich
der den Zollbeamten enstandenen Kosten. |
