|
(This document
in English)
PROCÉDURES D'IMPORTATION DE LA FDA
|
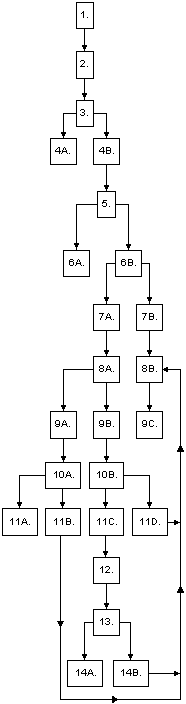 |
1. | L'importateur ou son représentant enregistre les documents
d'entrée au Service des Douanes Américaines dans les cinq jours
à partir de la date d'arrivée des marchandises au port
d'entrée.
|
| 2. | La FDA est avisée de l'entrée d'aliments
réglementés par :
- Doubles des documents d'entrée aux Douanes (CF 3461,
CF 3461 ALT, CF 7501 ou alternative)
- Un exemplaire de la facture commerciale et,
- Caution garantissant le paiement des droits de douane
possibles, taxes et pénalités.
|
|
3. | La FDA examine les documents d'entrée de l'importateur
pour déterminer le besoin éventuel d'une inspection physique,
d'une inspection sur les quais ou de l'examen d'échantillons:
|
|
4A. | S'il est décidé de ne pas prendre d'échantillon - la FDA
envoie un "Avis d'autorisation de continuer" aux Douanes
américaines et à l'importateur indiqué sur l'enregistrement.
Cette expédition est libérée, en ce qui concerne la FDA:
|
|
4B. | Il est décidé de prendre un échantillon sur les bases
suivantes:
- Nature du produit,
- Priorités de la FDA , et,
- Evénements précédents concernant ce produit.
La FDA envoie un "Avis d'échantillonnage" aux Douanes
Américaines et à l'importateur enregistré. L'expédition ne doit
pas être touchée jusqu'à avis complémentaire. Un échantillon
sera prélevé de l'expédition. L'importateur enregistré peut enlever
le chargement des quais et l'envoyer à un autre port ou
entrepôt ( contacter les douanes américaines pour plus
amples détails).
|
|
5. | La FDA obtient un échantillon physique. Celui-ci est
envoyé à un laboratoire régional de la FDA pour analyse.
|
|
6A. | Si l'analyse par la FDA détermine que le produit est
conforme aux exigences, la FDA envoit un "Avis de libération"
aux douanes et à l'importateur.
|
|
6B. | Si l'analyse par la FDA détermine que l'échantillon
"semble constituer une infraction à l'Acte FD&C et aux
autres actes associés", la FDA envoie un Avis de Détention
et d'audience aux douanes américaines et à l'importateur
enregistré; qui:
- Spécifie la nature de l'infraction et,
- Donne 10 jours ouvrables à l'importateur pour
présenter des témoignages attestant du caractère
admissible du chargement.
L'audience est la seule possibilité pour l'importateur
de présenter la défense de son importation et/ou la façon
dont le chargement peut devenir admissible à l'entrée.
|
|
7A. | Si,soit le consignataire, soit le propriétaire réel,
soit l'importateur enregistré ou un représentant désigné
répond à l'Avis de Détention et d'Audience, la réponse
permet l'introduction de témoignages, oralement ou par
écrit, concernant la possibilité d'admission du chargement
|
|
7B. | Si soit le consignataire, soit le propriétaire réel,
soit l'importateur enregistré ou un représentant désigné ne
répond pas à l'avis de détention et d'audience et ne demande
pas une extension de la période d'audience,
|
|
8A. | La FDA procède à une audience concernant l'admissibilité
du produit. L'audience représente la possibilité de présenter
des témoignages et ne considère que les attestations afférentes
au sujet considéré.
|
|
8B. | La FDA émet un Avis de refus d'admission à l'importateur
enregistré, c'est-à-dire à la même personne que celle
qui a reçu l'avis d'échantillonnage. Tous les destinataires
des avis d'échantillonnage et de détention et audience
reçoivent un exemplaire de l'avis de refus.
|
|
9A. | L'importateur enregistré présente des preuves indiquant la
conformité du produit. Les résultats d'analyses certifiés des
échantillons, examinés par un laboratoire reconnu et déterminés
se trouver dans les limites publiées des niveaux de contaminants
et défauts dans l'alimentation humaine, peuvent être
présentés.
|
|
9B. | L'importateur enregistré présente une Application for
Authorization
to Recondition or to Perform Other Action - Demande
d'autorisation de reconditionnement ou de prendre
d'autres mesures (FDA Form FD 766). Ce formulaire demande
la permission de tenter de ramener un aliment falsifié ou
à étiquetage falsifié à un état de conformité, soit par un
nouvel étiquetage soit par d'autres mesures, soit par sa
conversion en un usage non-alimentaire. La méthode
détaillée proposée pour amener la conformité de
l'aliment doit être fournie.
|
|
9C. | La FDA reçoit l'avis de vérification ou de destruction du
chargement par les Douanes Américaines. L'exportation ou la
destruction de la marchandise figurant sur l'Avis de refus
d'admission est exécutée sous la direction des Douanes U.S.
|
|
10A. | La FDA recueille des échantillons de suivi pour
déterminer la conformité aux directives.
|
|
10B. | La FDA évalue la procédure de reconditionnement
proposée par l'importateur. Une caution est exigée pour
le paiement des dommages liquidés.
|
|
11A. | Si la FDA détermine que l'échantillon est "conforme",
un Avis de libération contenant la déclaration "Détenu à
l'origine, puis libéré" est envoyé aux douanes américaines
et à l'importateur.
|
|
11B. | La FDA détermine que l'échantillon n'est pas conforme.
L'importateur peut soumettre soit une demande d'autorisation
de reconditionnement ou d'engager une autre action (voir 9B),
à défaut de quoi la FDA émet un Avis de refus d'admission
(voir 8B).
|
|
11C. | La FDA approuve les procédures de reconditionnement
de l'importateur. La demande approuvée contient la
déclaration "Cette marchandise ne doit pas être
touchée avant la réception de l'Avis de libération de
la FDA."
|
|
11D. | La FDA n'approuve pas la procédure de
reconditionnement s'il a été prouvé dans le passé que la
méthode proposée n'était pas satisfaisante. Une seconde
et dernière demande ne sera pas considérée à moins
qu'elle ne contienne des changements significatifs
assurant une possibilité raisonnable de résultats
satisfaisants. Le pétitionnaire est avisé par le formulaire
766 de la FDA.
|
|
12. | L'importateur termine toutes les procédures de
reconditionnement et avise la FDA que les marchandises
sont prêtes à l'inspection ou à l'échantillonnage.
|
|
13. | La FDA procède à une inspection/échantillonnage de
suivi pour confirmer la conformité aux termes de
l'autorisation de reconditionnement.
|
|
14A. | L'analyse de la FDA confirme que l'échantillon est
conforme. Un Avis de libération est envoyé à l'importateur
et aux douanes américaines. Les frais de supervision de la
FDA sont consignés sur le formulaire FD 790 de la FDA. Des
exemplaires sont envoyés aux douanes américaines, qui en
demanderont le paiement, y compris tous frais encourus par
leur personnel.
|
|
14B. | La FDA détermine que l'échantillon n'est toujours
pas conforme. Les frais de supervision de la FDA sont
consignés sur le formulaire FD 790 de la FDA. Des
exemplaires sont envoyés aux douanes américaines, qui
en demanderont le paiement, y compris tous frais
encourus par leur personnel.
|
